Investigadores de la Universidad Nacional de Quilmes en colaboración con colegas de la Universidad Técnica de Dresde de Alemania proponen un nuevo paradigma en torno al proceso de biosíntesis de insulina.
Investigadores del Grupo de Biología Estructural y Biotecnología de la Universidad Nacional de Quilmes vinculado al Instituto Multidisciplinario de Biología Celular (IMBICE–CONICET–UNLP) en colaboración con el laboratorio del Dr. Michele Solimena del Instituto Paul Langerhans y la Facultad de Medicina de la Universidad Técnica de Dresde, Alemania, publicaron recientemente nuevos avances en el estudio de la diabetes desde la perspectiva de la biología estructural moderna. El artículo fue publicado en la renombrada revista Protein Science.
ICA512 y fogrina son proteínas de membrana que se expresan en las células beta pancreáticas. En estas células, ambas proteínas están directamente involucradas en la biosíntesis y el recambio de los gránulos de secreción (GS) de insulina y su disfunción conlleva, en última instancia, al desarrollo de diabetes.
En los últimos años, los grupos de Argentina y Alemania se han enfocado en el estudio de un dominio particular de ICA512 denominada RESP18HD el cual guarda homología de secuencia con otra proteína de los GS denominada Proteína endocrina específica regulada (Resp18). El aumento de la concentración de glucosa estimula la expresión de estas proteínas que, a su vez, estimulan la biogénesis de nuevos GS de insulina en las células beta.
“Hace pocos años demostramos que RESP18HD inhibe la formación de fibras de tipo amiloide de insulina en experimentos in vitro y también demostramos que juntas—RESP18HD e insulina, aclara—forman partículas amorfas que precipitan”, explica la Dra. Pamela Toledo, becaria postdoctoral del CONICET y primera autora del trabajo. “En este trabajo—continúa—ampliamos los estudios de interacción de RESP18HD con la proteína precursora de la insulina, es decir, con proinsulina. La formación de los GS de insulina es el último eslabón de la cadena. Para ello, antes deben ocurrir numerosos procesos en diferentes condiciones fisicoquímicas y allí es dónde está involucrada la proinsulina”.
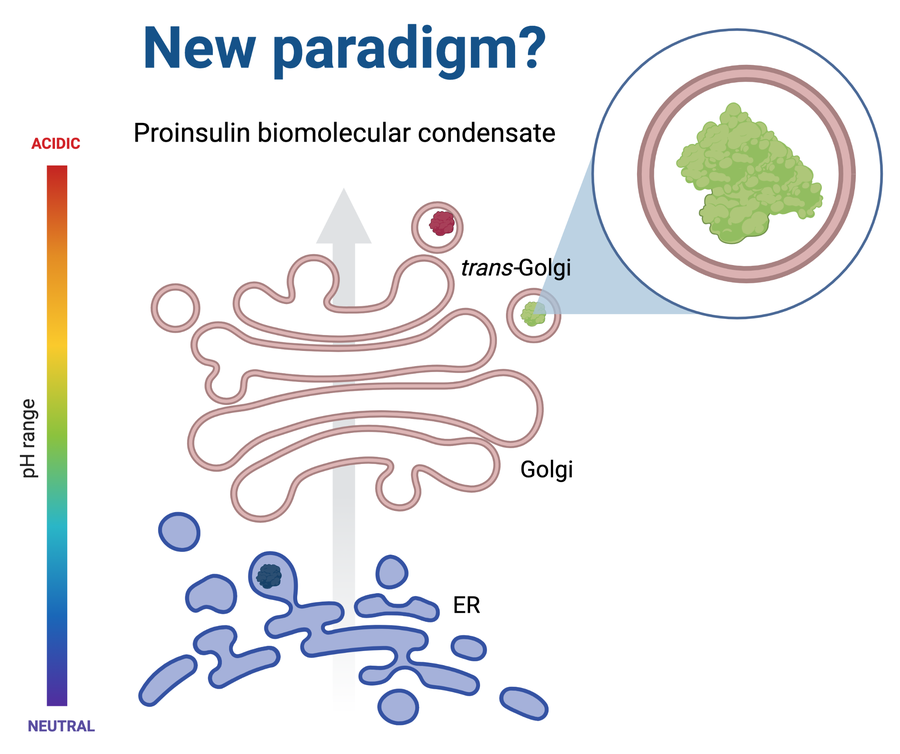
“Este trabajo se enmarca en un proceso biofísico y bioquímico que se encuentra en una etapa de intensa investigación en todo el mundo y es el de los condensados biomoleculares. Podemos imaginar que un biocondensado es como tener una gota de un líquido dentro de otro líquido que coexisten en armonía pero no se mezclan y esas gotas están formadas, en este caso, por una o más proteínas pero también por material genético como ARN y proteínas. Lo que nosotros logramos observar es que la proinsulina por sí sola es capaz de formar estos biocondensados a un pH similar al que se encuentra en la vía secretora”, agrega el Dr. Diego S. Vazquez, investigador del CONICET y coautor del trabajo. “Esta capacidad de la proinsulina seguramente tenga un rol muy importante en el correcto plegado de la proinsulina lo que permite que en última instancia se formen los depósitos de insulina correctamente y estén disponibles cuando el cuerpo lo necesite” agrega el investigador.
“Cada vez se encuentran más y más ejemplos de procesos celulares donde intervienen los condensados biomoleculares de forma normal pero también es un fenómeno asociado a numerosas enfermedades neurodegenerativas como el Alzheimer y fue observado en la formación y replicación de diferentes virus lo que transforma al tema es un hot topic“ agregan los investigadores.
Investigadores: Pamela L. Toledo. Becaria Postdoctoral CONICET Diego S. Vazquez. Investigador Asistente CIC-CONICET Alejo R. Gianotti. Becario Postdoctoral CONICET Milagros B. Abate. Estudiante Lic. Biotecnología UNQ Juha M. Torkko. UT, Dresde, Alemania Carolin Wegbrod. UT, Dresde, Alemania Michele Solimena. UT, Dresde, Alemania Mario R. Ermácora. Investigador Principal CIC-CONICET Link al artículo: Toledo PL, Vazquez DS, Gianotti AR, Abate MB, Wegbrod C, Torkko JM, Solimena M, Ermácora MR. Condensation of the β-cell secretory granule luminal cargoes pro/insulin and ICA512 RESP18 homology domain. Protein Sci. 2023 May 9. DOI: 10.1002/pro.4649.