Instituto Multidisciplinario de Biología Celular
La Plata, Provincia de Buenos Aires, Argentina
El IMBICE es una institución de investigación científica que aborda temas de importancia regional y nacional en áreas de medicina, genética humana y animal, neurociencias, biología estructural y biotecnología.
Actividades recientes
- Sesión de posters interdisciplinaria

- 15 de noviembre: Seminario externo – Martín Abba (CINIBA)

- 17 de octubre: Seminario Externo – Dr. Gustavo Somoza (INTECH)

Noticias recientes
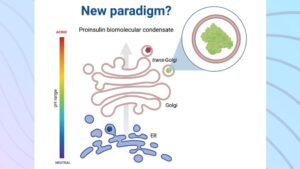
- Nuevos aportes de investigadores del CONICET sobre la biosíntesis de insulina
- Evidencia genética revela que la ocupación humana de Sudamérica habría ocurrido hace más de 18 mil años

- El CONICET lamenta el fallecimiento de Néstor Oscar Bianchi

- Científicos y científicas del CONICET reflexionan sobre el Premio Nobel de Medicina otorgado al fundador de la paleogenómica


